基因编辑技术,尤其是以CRISPR-Cas9为代表的工具,正在深刻改变生物医药领域,其在艾滋病(AIDS)治疗方面的探索尤为引人注目,艾滋病由人类免疫缺陷病毒(HIV)引起,病毒通过攻击CD4+ T淋巴细胞破坏人体免疫系统,目前虽可通过抗逆转录病毒疗法(ART)有效抑制病毒复制,但无法彻底清除潜伏病毒,患者需终身服药,基因编辑技术为实现“功能性治愈”甚至彻底根除HIV提供了全新思路,其核心在于通过精准修改宿主细胞基因组,阻断病毒生命周期或增强细胞抵抗力。

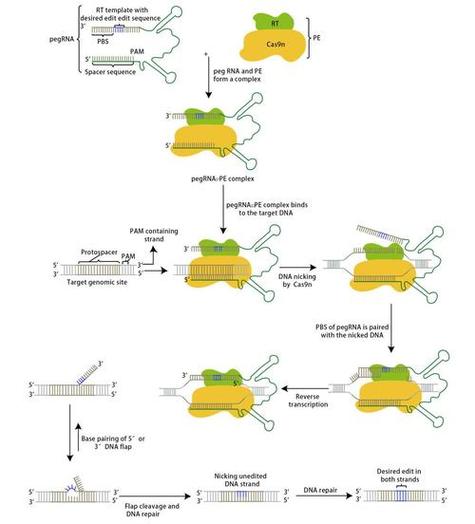
基因编辑技术靶向HIV的作用机制
基因编辑治疗AIDS的策略主要围绕三大方向:破坏病毒基因组、干扰病毒进入细胞的过程、以及赋予细胞抵抗病毒的能力,具体技术路径包括:
-
靶向HIV前病毒DNA
HIV感染后,其基因组会整合到宿主细胞DNA中形成前病毒,成为潜伏的病毒库,CRISPR-Cas9系统可通过设计向导RNA(gRNA)识别HIV前病毒DNA上的特异性序列(如gag、pol、env等基因),引导Cas9核酸酶切割并破坏病毒基因组,使其失活,研究表明,针对HIV LTR(长末端重复序列)的gRNA可有效切断前病毒DNA,阻止病毒转录和复制,新兴的碱基编辑器(Base Editor)和质粒编辑器(Prime Editor)可实现单碱基水平的精准突变,而非仅依赖DNA双链断裂,从而降低脱靶风险。 -
修饰宿主细胞受体
HIV主要通过CD4分子和辅助受体CCR5/CXCR4进入细胞,CCR5Δ32突变(第32位碱基缺失)可导致细胞表面CCR5受体缺失,使细胞天然抵抗HIV-1感染,基因编辑技术可模拟这一突变:通过CRISPR-Cas9破坏CCR5基因,或使用TALENs(转录激活因子样效应物核酸酶)敲除CCR5,使患者CD4+ T细胞获得类似“柏林病人”和“伦敦病人”的治愈效果——这两例通过造血干细胞移植治愈的艾滋病患者,其供体恰好携带CCR5Δ32突变,针对CCR5的基因编辑疗法已进入临床试验阶段,例如通过体外编辑患者造血干细胞或T细胞后回输,重建抗HIV的免疫系统。 -
构建“免疫细胞装甲”
除了破坏病毒或受体,基因编辑还可增强免疫细胞的战斗力,通过敲除PD-1基因(免疫检查点分子),解除T细胞的抑制状态,使其更有效地清除感染细胞;或通过插入CAR(嵌合抗原受体)基因,改造T细胞使其特异性识别并杀伤HIV感染细胞,针对HIV潜伏的“激活-清除”策略,可编辑细胞内调控病毒复制的因子(如Tat蛋白),增强潜伏病毒的激活,配合ART或免疫疗法彻底清除病毒库。 (图片来源网络,侵删)
(图片来源网络,侵删)
技术挑战与安全性考量
尽管前景广阔,基因编辑治疗AIDS仍面临诸多挑战,首先是脱靶效应,即gRNA可能错误切割非目标DNA序列,导致基因突变或细胞癌变,通过优化gRNA设计、开发高保真Cas9变体(如eSpCas9、HiFi-Cas9)以及改进递送系统(如脂质纳米颗粒LNP、腺相关病毒AAV),可显著降低脱靶风险,其次是递送效率,如何将基因编辑工具精准递送到体内潜伏病毒所在的特定组织(如淋巴结、肠道相关淋巴组织)仍是难点,体外编辑细胞后回输是主流策略,但体内直接递送的研究也在加速,例如利用AAV载体递送CRISPR组件。
病毒变异性和潜伏库清除不彻底是核心问题,HIV高突变率可能导致病毒逃逸编辑,因此需设计针对高度保守区域的gRNA;而潜伏病毒库分布在多种细胞中,单一编辑策略难以彻底清除,可能需要联合多种基因编辑靶点或与其他疗法(如“激活-清除”策略、治疗性疫苗)协同作用。免疫原性也不容忽视,Cas9蛋白来源于细菌,可能引发宿主免疫反应,导致编辑细胞被清除或引发炎症反应。
临床研究进展与未来方向
近年来,基因编辑治疗AIDS的临床试验已取得初步成果,2025年,一项I期临床试验通过CRISPR-Cas9编辑患者CD4+ T细胞的CCR5基因,回输后患者体内未观察到严重不良反应,且部分患者病毒载量下降,针对HIV前病毒的编辑研究在体外模型和动物实验中显示出显著效果,如人源化小鼠模型中,CRISPR介导的病毒DNA切割可使血浆病毒载量降低99%以上。
未来研究将聚焦于:
- 提高编辑特异性与效率:开发新型编辑工具(如表观遗传编辑沉默病毒基因)和智能递送系统,实现组织或细胞特异性靶向。
- 联合疗法优化:将基因编辑与ART、免疫检查点抑制剂、治疗性疫苗等结合,协同清除病毒库并防止复发。
- 个体化治疗:根据患者HIV基因型、免疫状态和病毒库特征,定制个性化编辑方案。
- 安全性长期评估:通过长期随访监测基因编辑的长期副作用,如潜在的致瘤风险或免疫异常。
相关问答FAQs
Q1: 基因编辑治疗AIDS与现有抗逆转录病毒疗法(ART)相比,优势是什么?
A: ART通过抑制HIV复制控制病情,但无法清除潜伏病毒库,患者需终身服药且可能产生耐药性,基因编辑技术的优势在于:① 从根源上破坏或清除HIV基因组,有望实现“功能性治愈”(无需服药维持病毒抑制);② 通过修饰宿主细胞(如CCR5敲除)提供长期抵抗力,减少对药物的依赖;③ 可联合其他策略彻底清除病毒库,而ART仅能抑制病毒活性,基因编辑仍处于临床试验阶段,其安全性和有效性需进一步验证,而ART已成熟且广泛应用,两者并非替代关系,而是未来可能协同的互补疗法。
Q2: 基因编辑治疗AIDS面临的最大伦理挑战是什么?
A: 基因编辑治疗AIDS的伦理挑战主要集中在三方面:① 安全性不确定性:脱靶效应、长期健康风险等可能对患者造成不可逆伤害,尤其在临床试验中需严格评估风险收益比;② 公平性与可及性:技术的高昂成本可能导致资源分配不均,加剧医疗资源差距,需确保全球患者尤其是低收入人群的公平获取;③ 生殖系编辑界限:若技术应用于生殖细胞(如精子、卵子),其遗传改变可传递给后代,涉及人类基因库的永久性修改,目前国际共识仅允许体细胞编辑用于疾病治疗,且需严格监管,对HIV感染者进行基因编辑可能涉及隐私歧视问题,需加强伦理审查和法律保障。